导读
本文强调了在进行功能性近红外光谱(fNIRS)研究时需要考虑和解决的一个重要问题,即无意中测量非神经血管耦合引起的fNIRS血流动力学反应的可能性。这些可能被误解为大脑活动,即“假阳性”(由于错误地将检测到的血流动力学反应分配给功能性大脑活动而引起的错误),或掩盖大脑活动,即“假阴性”(错误地将未观察到的血流动力学反应分配给功能性大脑活动所造成的错误)。在这里,本文总结了这些问题可能的生理起源,并提出了避免和消除它们的方法。
功能近红外光谱信号的变化代表神经元活动,但并非总是如此
功能近红外光谱(fNIRS)是一种应用日益广泛的神经科学研究方法。它是一种基于血流动力学的功能脑成像技术,类似于功能磁共振成像(fMRI),依靠检测神经血管耦合来推断神经元活动的变化。神经血管耦合是指局部神经活动的变化与局部脑血流量(CBF)的变化相关。CBF变化的大小和空间位置与神经元活动的变化密切相关。神经元兴奋引起与神经血管耦合相关的氧化代谢变化(神经代谢耦合);血管扩张导致CBF和脑血容量增加,从而过度补偿代谢需求。这种含氧血过量供应(功能性充血)的原因仍然存在争议,它导致fNIRS测量的氧合血红蛋白([O2Hb])增加,脱氧血红蛋白([HHb])减少,总血红蛋白([tHb]=[O2Hb]+[HHb])增加。尽管这种生理现象是众所周知和意料之中的,但在出版物中往往没有完全呈现(作者往往只关注[O2Hb]响应)。此外,这种[O2Hb]、[HHb]和[tHb]的变化模式可能并非仅由神经血管耦合引起。
本文的目的是(i)定义和强调fNIRS中的假阳性和假阴性问题,(ii)描述识别这些问题的一些挑战,最后(iii)提出解决这一问题的方法。(本文明确假设fNIRS仪器可以准确监测和解析[O2Hb]和[HHb]的浓度变化。fNIRS仪器的技术规格和配置(例如,光源和光电探测器的类型和数量)可以指示设备在监测[O2Hb]和[HHb]时的性能和准确性。其中一个方面,特别是用于分辨[O2Hb]和[HHb]的波长的数量和范围,因为据报道,某些波长组合会导致发色团之间的“串扰”。这种串扰可能使描述一种发色团浓度的真实变化也会引起另一种测量浓度的虚假变化的现象;有关此问题的更详细讨论,请参阅Scholkmann等人(2014)综述文章中的“最佳波长的选择”部分,以及Arifler等人(2015)的研究。作者在其研究中使用的fNIRS波长被认为是一种良好实践)。
什么是功能近红外光谱中的假阳性和假阴性?
本文使用术语“假阳性”或“假阴性”来说明,在功能性实验期间,覆盖在皮层某一区域的测量通道上的fNIRS信号变化([O2Hb],[HHb]和[tHb])可能不是由于神经血管耦合的影响,也可能是由于(i)与任务相关的全身活动引起的脑内血流动力学或(ii)脑外血流动力学的变化。这些与任务相关的全身性变化可能类似于神经元诱导的血流动力学反应(假阳性),或者可以减弱(掩盖)神经元诱导的血流动力学反应(假阴性)。
假阳性和假阴性的存在并非是fNIRS独有的问题,而是所有基于血流动力学的脑功能成像技术(包括fMRI)的问题。然而,fNIRS对脑外(浅表)室血流动力学和氧合变化的敏感性是该技术的一个特殊混杂因素。
fNIRS被越来越多地用于研究复杂的认知功能,其中一些可以引起系统变量的显著变化,从而导致大脑和脑外室中发生非神经元驱动的血流动力学/氧合变化,主要与心率(HR)、血压、呼吸频率、血液中的CO2浓度和自主神经系统(ANS)活动的变化有关。
这些系统性效应的存在,以及它们对fNIRS测量结果的影响,在很大程度上取决于功能协议(例如,被动任务与主动任务)和所研究的被试(例如,两个人对同一压力源的反应可能截然不同)。
哪些因素会导致功能近红外光谱中的假阳性和假阴性?
每个fNIRS信号都包含不同的组成部分,可以根据其(i)来源(脑内与脑外),(ii)刺激/任务关系(诱发与非诱发),以及(iii)生理原因(神经元与系统性)进行分类。fNIRS旨在检测的由神经血管耦合引起的血流动力学反应只是这些组分之一(即神经元/任务诱发/大脑成分),而所有其他组分都是在fNIRS研究中充当混杂因素的生理噪声(见图1)。
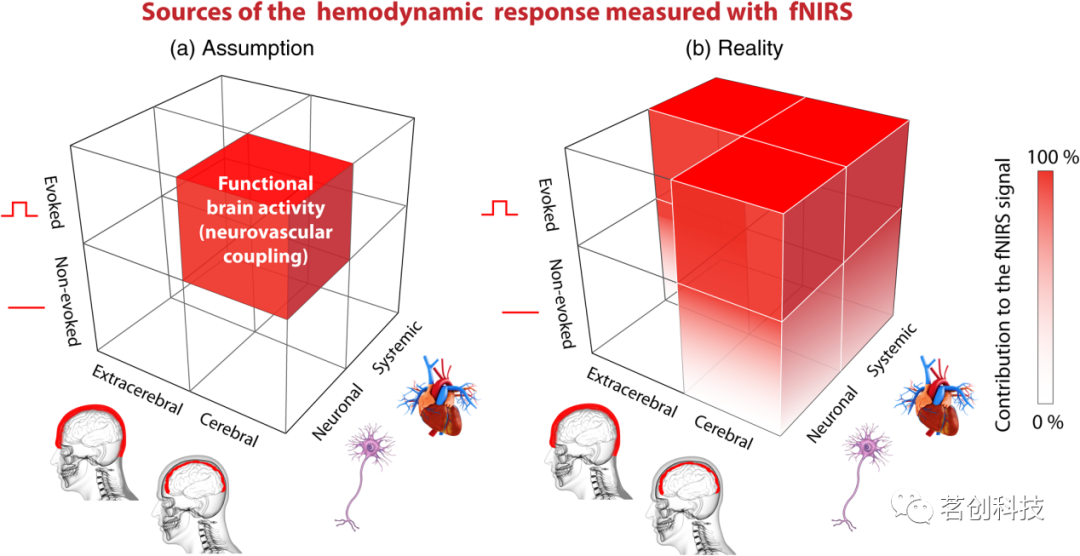
图1.fNIRS信号([O2Hb],[HHb],[tHb])的六个组分的可视化。(a)一个错误的假设是,fNIRS信号仅代表与神经血管耦合引起的功能性大脑活动相关的变化。(b)实际上,fNIRS信号包含六个组分,因此在每项fNIRS研究中,有五个组分可能是混淆因素。这些组分对fNIRS信号的贡献通过颜色编码(红色:100%,白色:0%)可视化。非诱发/脑/神经元和非诱发/脑/系统性组分可在很大程度上影响fNIRS信号;然而,在评估功能性、任务相关大脑活动的实验范式中,诱发的变化通常会更强。
多模态fNIRS(即fNIRS研究包括使用其他监测设备测量全身生理变化)研究了不同的任务,例如说话(最大效应:ΔPaCO2≈-9 mm Hg)、心算(ΔPaCO2≈0.5至3 mm Hg)和内部言语(即不出声的言语活动,ΔPaCO2≈-0.5 mm Hg),证实了任务诱发的呼吸和呼气末二氧化碳分压(PETCO2)的变化,这是对动脉血二氧化碳分压(PaCO2)的可靠和准确估计。
任务诱发的平均动脉血压变化(ΔMAP)已在许多不同的实验性fNIRS协议中得到证实,例如,抬臂(ΔMAP≈6 mm Hg)、视觉刺激(ΔMAP≈2 mm Hg)、解字谜(ΔMAP≈3至5 mm Hg,6至7 mm Hg)、高碳酸血症(ΔMAP≈4 mm Hg)、低碳酸血症(ΔMAP≈4.5 mm Hg;ΔMAP≈-10 mm Hg)、低氧血症(ΔMAP≈2 mm Hg)和高氧血症(ΔMAP≈2 mm Hg)。
由于MAP是心输出量(CO)、体循环阻力(SVR)和中心静脉压(CVP)的函数(MAP=CO×SVR+CVP),由于CO是HR和每搏输出量(SV)的乘积(CO=HR×SV),任务诱发的HR和SVR的变化也会对MAP产生影响。
任务诱发的ANS活动变化是另一个可能影响fNIRS信号的因素,因为ANS直接影响CO、SVR,特别是脑外层的血流量(BF)。所有这三个生理变量(即导致CO2变化的呼吸、血压和ANS活动)都影响脑内和脑外隔室的BF(即头皮BF、ScBF)。CBF或ScBF的变化都可能对记录到的fNIRS信号产生影响。
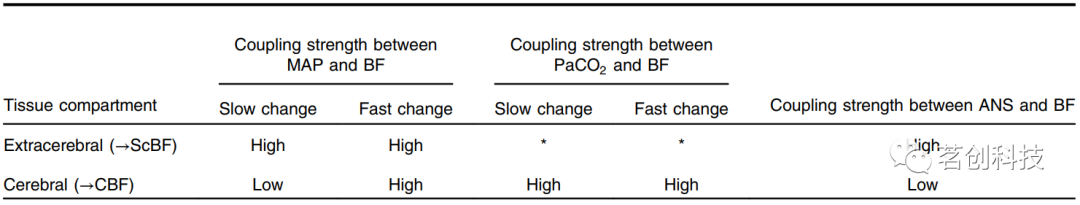
血压、CO2或ANS活动变化与BF变化之间的耦合强度至少取决于两个因素:(i)脑隔室类型(脑内vs脑外)和(ii)变化速度(慢vs快,即分钟范围vs秒范围)。表1显示了基于现有生理知识的耦合强度值。有趣的是,除了血压和CBF缓慢变化之间的耦合受到动态大脑自动调节的限制外,所有情况下的耦合通常都相当强。然而,需要注意的是,最近的文献中也存在对大脑自动调节效率的争议性讨论,对传统描述的CBF传递函数的形状和边界提出了质疑。
表1.BF与血压、PaCO2和ANS活动等系统变量之间的耦合强度概述(根据已有文献和经验)。“*”表示目前耦合强度未知或讨论存在争议。脑层血流动力学变化之间的耦合与CBF有关,而脑外隔室的变化与头皮BF有关。
脑外混淆因素是一个问题,因为fNIRS中的漫反射光在头部的脑外组织层中显著减弱,而不仅仅是在脑内隔室。在头部组织层中发射的光的穿透深度(D)基本上小于扩散近似所预测的源-探测器分离(SDS)的一半(即D<0.5 SDS)。脑外层血流动力学和氧合的变化会对fNIRS信号产生强烈的影响。这个问题原则上已存在很多年了,但随着越来越多的研究表明fNIRS受这些脑外变化的影响,而且脑外血流动力学变化具有空间异质性,其真正的意义变得越来越明显。
如何避免或消除fNIRS研究中的假阳性和假阴性?
假阳性和假阴性可以通过以下一种或多种方法来避免、最小化或处理(重要性不分先后):(i)精心的实验设计(例如,避免具有强烈系统激活的任务,避免对被试造成额外的压力和不适),(ii)深度分辨fNIRS技术[例如,多距离(MD)测量],(iii)适当的统计或信号处理方法[例如,独立成分分析(ICA),主成分分析(PCA),自适应滤波,使用系统回归量的一般线性模型(GLM)进行分析],(iv)多模态监测(例如,局部ScBF测量或系统生理信号测量)。
(一)设计fNIRS方案:与任何神经科学研究一样,在选择试验设计、确定实验任务、设计对比以及选择重复和持续时间时都应仔细考虑。设计fNIRS方案时需要考虑的基本方面是,大脑激活必须相对于对照条件或基线进行评估。功能性方案需要具有最佳的基线条件,以从实验任务中减去“虚假的”血流动力学/氧合反应。因此,fNIRS方案必须在实验条件和基线条件之间或两个实验条件之间产生高对比度。
(二)fNIRS仪器:关于fNIRS硬件优化,有多种可能性可以减少记录信号中生理干扰因素的影响。时域fNIRS设备提供了一种可能性,可以根据测量的时域光子点扩散函数而自动区分脑内或脑外层的测量变化。最近发表了用于分离脑外和脑内隔室贡献的新算法和方法。对于连续波fNIRS(cw-fNIRS)和频域fNIRS系统,MD测量通过计算光强度下降作为SDS函数的斜率来提高对脑室的灵敏度。MD方法可以通过两种主要技术“空间分辨光谱”和“自校准法”来实现。另一种可能性是使用额外的短通道记录。然后,这些短通道的信号可用于消除来自脑外层的影响。这种短通道回归的最佳SDS最近确定为成人8.4mm,足月婴儿2.15mm。所用短通道的数量和位置应以解剖学/生理学约束为指导,正如Zhang等人(2015)所讨论的那样。减少生理混淆的特定信号处理和数据分析方法包括使用来自短通道的信息或基于[O2Hb]和[HHb]的不同动态的方法。有关这些方法的概述,请参阅Scholkmann等人(2014)中的“提取大脑功能性活动的信号分析方法”部分,以及Tak和Ye(2014)的综述。
另一个需要考虑的方面是光电器件的连接。通常认为,将光电器件紧密连接到头皮上可以通过挤压头皮血液来消除或最小化脑外污染。虽然这是正确的,并且可能有助于减少脑外层血流动力学变化的影响,但必须注意的是,头部的高探头压力可能导致不适和局部疼痛,从而激活ANS,导致系统性混淆因素的强度增加。
探头压力也可以变化,与MD测量相结合,Baker等人(2015)开发的一种方法可以用于从fNIRS信号中去除脑外层的血流动力学影响。
(三)分析工具和方法:在单一框架内分析所有这些信号是具有挑战性的。一种可能性是采用GLM,其中生理信号是额外的回归量,这已经在一些研究中得到了证明。此外,在同一模型中同时使用[O2Hb]和[HHb]可以增强对血流动力学反应的正确检测,并改善统计。另一种有用的方法是将ICA与MD测量相结合。将ICA方法与系统测量相结合是一种很有前景的方法。Kirilina等人(2013)提出了一种去噪算法,该算法使用了从fNIRS和系统信号之间的时间依赖性得出的回归量。此外,PCA在分离fNIRS信号中的全局和局部成分方面的有效性也得到了验证。
由于任务诱发的系统性生理变化的强度在很大程度上取决于被试的特定心理生理状态,因此个体水平数据分析对于避免假阳性和假阴性也很重要。个体水平和组水平分析的结合可能是最佳的方法。
(四)多模态监测:fNIRS实验环境允许在功能实验过程中与其他可以监测系统变量的仪器轻松交互。这些设备可以测量MAP、呼吸、PETCO2、HR、皮肤电和ScBF。这些测量结果可用于识别那些表现出与任务相关的系统性变化较大的个体,这些变化可能会干扰大脑功能反应,从而将其排除在进一步的分析之外。这些测量结果也可以用来验证基线和实验任务条件之间的系统相似性。重要的是,这些测量值可以在统计和信号处理方法中作为回归和独立成分来解释非神经元相关的功能反应。
上述重点关注的是功能范式中的fNIRS监测,但当没有功能对比时,即在评估静息态大脑活动的研究中,还需要考虑其他问题。在静息态下,神经元和非神经元血流动力学因素并存,所以在设计实验方案时应考虑这些因素[例如,可能的环境噪声,实验期间睡意增加导致静息态活动的变化,由于fNIRS光电连接导致的被试压力增加,这可能会引起不愉快的感觉,从而导致ANS活动的变化]。在进行静息态fNIRS研究时应注意这样一个事实,即越来越多的研究报告了系统性血流动力学变化对静息态fNIRS和fMRI信号的影响。例如,Tong等人(2015)的fMRI研究表明,静息态“可能在某种程度上反映的是与系统性波动相关的血流变化,而非神经元连通性”。此外,在Zhu等人(2015)的静息态(RS)fMRI研究中,他们“提出了一个关键问题,即大部分rs-fMRI信号是否可以归因于脑血流动力学上游变化所产生的血管效应”。由于fNIRS信号还受到ScBF变化的影响,因此需要仔细解释静息态fNIRS信号。因此,在静息态fNIRS研究中,将测量的连通性相应地命名为“血管连通性”或“脑内外血流动力学功能连通性之和”是有道理的。
未来方向
为了改进未来的fNIRS研究,需要考虑许多因素。需要立即认识到的是,在fNIRS数据分析中,在得出任何神经科学结论之前,必须同时考虑[O2Hb]和[HHb]信号的时间动力学,以及它们之间的相互关系。同时报告[O2Hb]和[HHb]的变化,而不是仅报告其中一个,这样可以更好地对功能实验结果进行生理学解释(例如,当[O2Hb]和[HHb]在任务期间均显示出强烈的增加/降低时,那么这些信号有可能与系统性变化相混淆)。然而,观察功能激活过程中典型的血流动力学反应模式(即[O2Hb]增加和[HHb]降低)不足以得出没有系统性混淆效应发生的结论。系统生理的同步测量,目前可以通过高度便携且相对便宜的仪器轻松实现,同时可以提供一种可行的方法来消除系统性干扰,并识别与任务相关的系统性变化较强的个体。
[O2Hb]和[HHb]均可受系统性生理变化(发生在脑内或脑外隔室)的影响。然而,影响的程度往往各不相同,也取决于系统性变化的来源和类型。Kirilina等人证明[O2Hb]信号受脑外和脑内隔室的全局加工以及局部头皮BF调节的影响更强,而[HHb]信号受脑外过程的影响较小。其生理原因可能是来自交感神经系统的纤维对小动脉的神经支配程度大于小静脉;在ANS活动期间,[O2Hb]信号似乎比[HHb]信号受到的影响更大——Haeussinger等人(2014)的研究也支持这一结论。此外,众所周知,与[HHb]相比,[O2Hb]的心脏振荡更明显。尽管有证据表明[HHb]信号受系统性变化的污染较小,但这并不意味着[HHb]信号没有受到系统性变化的干扰。
在目前的fNIRS研究中,大多数研究使用cw-fNIRS系统,该系统仅在固定的3cm SDS上进行测量。在这种情况下,建议通过以下任一方式校正ScBF效应:(i)添加额外的短通道并使用它们回归表面血流动力学(使用目前开发的短通道回归方法之一),(ii)通过计算所有通道的平均信号并使用该通道作为表面回归量,或(iii)结合这两种方法。
目前,越来越多的fNIRS仪器公司提供替代或附加解决方案,以允许使用随后的短通道回归框架实现MD探头几何形状。未来,这种仪器的进步将允许fNIRS测量能够更好地代表神经元、大脑和诱发反应。
参考文献:
Tachtsidis, I. , & Scholkmann, F., “Publisher’s note: false positives and false negatives in functional near-infrared spectroscopy: issues, challenges, and the way forward. Neurophotonics,” Neurophotonics 3(3), 031405 (2016).
F. Scholkmann et al., “A review on continuous wave functional nearinfrared spectroscopy and imaging instrumentation and methodology,” NeuroImage 85(Pt 1), 6-27 (2014).
D. Arifler et al., “Optimal wavelength combinations for near-infrared spectroscopic monitoring of changes in brain tissue hemoglobin and cytochrome c oxidase concentrations,” Biomed. Opt. Express 6(3), 933-947 (2015).
Y. Zhang et al., “Multiregional functional near-infrared spectroscopy reveals globally symmetrical and frequency-specific patterns of superficial interference,” Biomed. Opt. Express 6(8), 2786-2802 (2015).
S. Tak and J. C. Ye, “Statistical analysis of fNIRS data: a comprehensive review,” NeuroImage 85(Pt 1), 72-91 (2014).
W. B. Baker et al., “Pressure modulation algorithm to separate cerebral hemodynamic signals from extracerebral artifacts,” Neurophotonics 2(3), 035004 (2015).
E. Kirilina et al., “Identifying and quantifying main components of physiological noise in functional near infrared spectroscopy on the prefrontal cortex,” Front. Hum. Neurosci. 7, 864 (2013).
Y. Tong et al., “Can apparent resting state connectivity arise from systemic fluctuations?,” Front. Hum. Neurosci. 9, 285 (2015).
D. C. Zhu et al., “Vascular coupling in resting-state fMRI: evidence from multiple modalities,” J. Cereb. Blood Flow Metab. 35(12), 1910-1920 (2015).
F. B. Haeussinger et al., “Reconstructing functional near-infrared spectroscopy (fNIRS) signals impaired by extra-cranial confounds: an easyto-use filter method,” NeuroImage 95, 69-79 (2014).